الهندسة النسيجية والطباعة الحيوية
قال تعالى: (وَاللَّهُ جَعَلَ لَكُمْ مِنْ بُيُوتِكُمْ سَكَنًا وَجَعَلَ لَكُمْ مِنْ جُلُودِ الْأَنْعَامِ بُيُوتًا تَسْتَخِفُّونَهَا يَوْمَ ظَعْنِكُمْ وَيَوْمَ إِقَامَتِكُمْ وَمِنْ أَصْوَافِهَا وَأَوْبَارِهَا وَأَشْعَارِهَا أَثَاثًا وَمَتَاعًا إِلَى حِينٍ)
الهندسة النسيجية والطباعة الحيوية: ثورة في الطب التجديدي:
1. مقدّمة في الهندسة النسيجية والطباعة الحيوية: ثورة في الطب التجديدي
الهندسة النسيجية (Tissue Engineering) والطباعة الحيوية (Bioprinting) تشكّلان تحوّلًا ثوريًا في ميدان الطب التجديدي، حيث تتيح للمختصين تصميم أنسجة وأعضاء اصطناعية تحمل وظائف بيولوجية قابلة للنمو والتكامل داخل الجسم. الهدف هو استبدال أو إصلاح الأنسجة المتضرّرة بطريقة مخصصة تتوافق مع احتياجات المريض، مع تقليل رفض الجهاز المناعي وتحسين فرص الشفاء.
في السنوات الأخيرة، تطوّرت الطباعة الحيوية لتشمل ليس فقط إنتاج أشكال ثابتة ثلاثية الأبعاد، بل أيضًا أنسجة “ذكية” قابلة للتكيّف مع البيئة الداخلية – ما يُعرف بالطباعة الحيوية رباعية الأبعاد (4D bioprinting).
الكلمات المفتاحية المهمة في هذا المجال التي يُنصح بدمجها في المحتوى تشمل: “الهندسة النسيجية”، “3D bioprinting”، “4D bioprinting”، “الأنسجة الذكية القابلة للتكيّف”، “المواد الحيوية الذكية”، “التوافق الحيوي”، و “الخلايا الجذعية للطباعة الحيوية”.
2. مفهوم الطباعة الحيوية ثلاثية الأبعاد (3D Bioprinting) وأساسياتها التقنية
2.1 ما هي الطباعة الحيوية ثلاثية الأبعاد؟
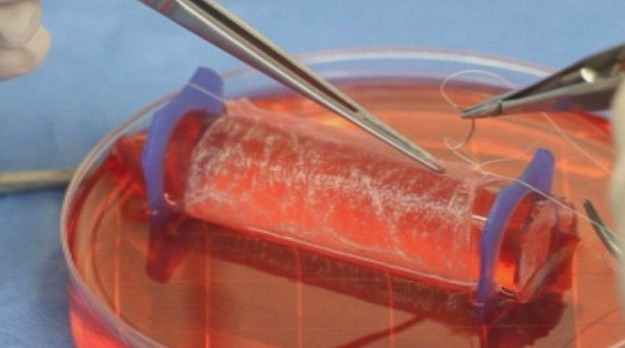
الطباعة الحيوية ثلاثية الأبعاد هي تقنية تصنيع مضاف (additive manufacturing) تُستخدم لبناء هياكل ثلاثية الأبعاد تحمل خلايا حية ومواد داعمة (bioinks) بشكل طبقي ومتزامن، بهدف محاكاة بنية ووظيفة الأنسجة الحقيقية. (pmc.ncbi.nlm.nih.gov)
2.2 خطوات العملية والمكوّنات الأساسية
- تصميم برمجي (CAD / النموذج الرقمي): يُنشأ نموذج ثلاثي الأبعاد يُعبّر عن البنية المرغوبة (سواء نسيج أو عضُو).
- تحضير الـ Bioink: مزيج من خلايا حية + مواد داعمة (هيدروجيل، بوليمرات طبيعية أو صناعية، عوامل نمو).
- الطباعة / الترسيب: تُستخدم طابعة حيوية لترسيب الـ bioink بدقة طبقة بعد طبقة.
- التمايز والنضج: بعد الطباعة، تُنقل البنية إلى بيئة مُحاكاة (حاضنة) للسماح للخلايا بالرّبط، النمو، والتمايز.
- الاختبار والوظيفة: تقييم الأنسجة المطبوعة من حيث البقاء، التكوين النسيجي، الوظائف البيولوجية والتكامل المحتمل.
2.3 تقنيات الطباعة الحيوية الثلاثية الأبعاد
- الطباعة بالحقن / النفث (Inkjet / droplet-based bioprinting): تُحقن نقاط صغيرة من الـ bioink عبر رؤوس نفث دقيقة.
- الطباعة بالبثق (Extrusion-based bioprinting): تُدفع المواد عبر فوهة (مثل مكبس) لبناء الطبقات—شائعة لتطبيقات الأنسجة ذات اللزوجة العالية.
- الطباعة بالليزر المساعدة (Laser-assisted bioprinting): تُستخدم نبضات ليزر لنقل نقاط من الخلايا والمواد الداعمة بدون استخدام فوهة مباشرة، مما يقلل الاحتكاك.
- الطباعة الضوئية / التجفيف / الاستيريوليثوغرافي (SLA / DLP / vat photopolymerization): تستخدم الضوء لتصلّب الهيدروجيلات أو البوليمرات الحساسة. (tandfonline.com)
2.4 مميزات ومحدوديات
المزايا:
- دقة في تشكيل البنى المعقدة
- إمكانية توزيع عدة أنواع خلايا في نفس البنية
- تخصيص الأنسجة حسب المريض
التحديات:
- مقاومة ميكانيكية منخفضة في بعض المواد
- مشاكل التغذية والتغذية الدقيقة (نقل الأكسجين والمواد المغذية إلى داخل البنية)
- الحفاظ على بقاء الخلايا وكفاءتها بعد الطباعة (BioMed Central)
- نقص المعايير التنظيمية والتوحيد في البروتوكولات (PubMed)
3. الطباعة الحيوية رباعية الأبعاد (4D Bioprinting): الأنسجة القابلة للتغير الذاتي
3.1 ما هو 4D Bioprinting؟
الطباعة الحيوية رباعية الأبعاد (4D bioprinting) هي امتداد لتقنيات 3D bioprinting، حيث يُضاف البعد الزمني: تُطبع بنية قادرة على التغيير الذاتي أو التكيف بمرور الوقت استجابة لمحفزات بيئية (مثل الحرارة، الرطوبة، الأس الهيدروجيني، المجال الكهربائي/المغناطيسي، البنى الحسية). (pmc.ncbi.nlm.nih.gov)
3.2 آليات التغيير والتكيف
يتم توظيف مواد استجابية (stimuli-responsive materials) أو هيدروجيلات ذكية، قادرة على التمدد، الانكماش، التصلّب أو التشكّل تلقائيًا عند التعرض لمحفز معين. (MDPI)
أمثلة على المحفزات المحتملة:
- الحرارة: تحول المواد من شكل إلى آخر بدرجة حرارة معينة
- الرطوبة / الماء: امتصاص الماء يغيّر حجم الهياكل
- الأس الهيدروجيني (pH): تغيير الشكل أو إطلاق عوامل علاجية عند تغير pH
- الحقول الكهربائية أو المغناطيسية: تحفيز الحركة أو الالتفاف
- الإنزيمات/العوامل البيولوجية: تفاعل مع مستقبلات في البيئة الحيوية داخل الجسم
3.3 الفوائد العظمى
- القدرة على التكيف الذاتي مع البيئة الداخلية للمريض
- تقليل الحاجة إلى تدخل جراحي كبير بفضل الأنسجة القادرة على التوسع أو التغير بعد الزرع (link.springer.com)
- دعم عمليات النمو، التمايز أو التجديد عند الحاجة
- تصميم هياكل قابلة للتقلّص أو التمدد– مثلاً في الأنسجة القلبية أو الغضروفية
3.4 التحديات والمعوقات
- محدودية المواد التي تجمع بين الاستجابة والمتانة البيولوجية
- التعقيد في برمجة الحركة أو التغير الزمني بدقة
- صعوبة التكامل بين الخلايا والمواد المتغيرة
- المخاوف من السلامة البيولوجية على المدى الطويل
4. المواد الحيوية الذكية (Smart Biomaterials) ودورها في استجابة الأنسجة للبيئة الداخلية
4.1 تعريف وخصائص المواد الحيوية الذكية
المواد الحيوية الذكية هي تلك التي تستجيب تلقائيًا لتحفيزات معينة (مثل الحرارة، الأس الهيدروجيني، القوة الميكانيكية، مجالات كهربائية أو مغناطيسية) من خلال التغيير البنيوي أو الوظيفي. تستخدم هذه المواد كأجزاء من bioinks أو كسقالات (scaffolds) في الطباعة الحيوية 3D/4D. (MDPI)
4.2 أنواع المواد الذكية المستخدمة
- الهيدروجيلات الاستجابية (Smart Hydrogels): مثل بوليمرات قابلة للترطيب أو التقلّص بتأثير الحرارة أو الرطوبة.
- بوليمرات ذاكِرة الشكل (Shape-memory Polymers, SMPs): تحتفظ بشكل مؤقت وتعود إلى شكلها الأصلي عند تحفيز معين.
- البوليمرات التي تستجيب لـ pH أو إنزيمات: تتفكّك أو تتغيّر في بيئات حمضية أو في وجود إنزيمات.
- المواد الكهروضوئية أو الموصّلة: التي تستجيب للجهد الكهربائي أو المجالات المغناطيسية لتحفيز التغيير البنيوي أو إطلاق الجزيئات العلاجية.
- النيوماتيك الحيوي (Bio-nanocomposites): دمج جزيئات نانومترية (مثل nanoparticle, مغناطيسية أو موصلة) داخل البوليمر لتمكين الاستجابة المغناطيسية أو الكهربائية. (sciencedirect.com)
4.3 دورها في التكيّف البيولوجي للأنسجة
- التحكّم الموجّه: إطلاق عوامل النمو، الأدوية، أو الجزيئات المساعدة بالضبط في مواقع مستهدفة داخل الجسم
- تعديل الصلابة الميكانيكية ديناميكيًا: لتتناسب مع النمو النسيجي أو التحميل الميكانيكي
- الاستجابة للتغيرات الجوية أو البيئية: مثل تغيّر الحموضة أو الأوكسجين في الأنسجة
- تحسين التفاعل مع الخلايا: تحفيز التمايز أو النمو وفقًا للمنبهات البيولوجية
5. الخلايا الجذعية والتقنيات الخلوية في بناء الأنسجة الحيوية الوظيفية
5.1 المصادر الخلوية المستخدمة
- الخلايا الجذعية متعددة القدرات (Multipotent stem cells): مثل الخلايا الجذعية الجنينية أو المشتقة من الدم الحبل السري
- الخلايا الجذعية المتخصصة / الأنسجة المولّدة داخل الجسم (Progenitor cells)
- الخلايا المشتقة من المريض (Autologous cells): لتقليل خطر الرفض
- الخلايا المحفّزة من نوع iPSCs (Induced Pluripotent Stem Cells): تحويل خلايا البالغين إلى خلايا جذعية متعددة القدرات
5.2 التحدي في بقاء الخلايا وتمايزها
الحفاظ على الحيّوية (viability) والوظيفة الخلوية بعد عملية الطباعة يُعدّ تحديًا كبيرًا، وذلك بسبب الإجهاد الميكانيكي، التشوّه، أو التعرض للإشعاع/الحرارة في بعض تقنيات الطباعة. (BioMed Central)
التقنيات التي تُستخدم لتقليل الضرر تشمل:
- استخدام bioinks ذات لزوجة منخفضة / خصائص shear-thinning
- تحسين تصميم الفوهات والضغط
- معالجة بعدية (post-processing) في بيئات داعمة
- استخدام مواد داعمة تحفّز التغذية وانتقال الأكسجين جيدًا
5.3 التكامل الخلوي والمصفوفة خارج الخلية (ECM)
- تضمين ببتيدات نشطة أو عوامل نمو داخل المواد الداعمة لتحفيز التصاق الخلايا والانتشار
- تصميم هياكل نانوية / مضافة تحاكي البنية الميكروسكوبية للمصفوفة خارج الخلية (Extracellular Matrix, ECM)
- استخدام التعاون المتعدد الخلوي (co-culture) لتوفير إشارات خلوية متبادلة وتحسين التعشيق النسيجي
5.4 التطويع الجيني والبيولوجي
- تعديل الخلايا وراثيًا لتعزيز قدرتها على إفراز عوامل النمو أو التعامل مع الإجهاد
- استخدام نانومواد أو ناقلات داخل الخلايا لتعزيز التمايز أو البقاء في البيئة المطبوعة
6. آليات التكيف الذاتي للأنسجة الحيوية داخل الجسم (Self-adaptive Tissue Systems)
6.1 المفهوم والوظيفة
الأنسجة الذاتية التكيف هي تلك القادرة على تعديل بنيتها، خصائصها الميكانيكية أو إفراز المواد بناءً على التغيرات في البيئة الحيوية، مثل التحميل الميكانيكي، الجوع بالأكسجين، الحموضة المتغيرة، أو العمليات الالتهابية.
6.2 استراتيجيات التصميم
- الهياكل متعددة المراحل (Multi-phase structures): أجزاء صلبة وأخرى مرنة يمكنها الانتقال بين الحالات
- البرمجة الزمنية (Temporal programming): تصميم مواد تتغير تدريجيًا بمرور الوقت
- التحفيز المدمج (Embedded stimulation): إدماج مجسات واستجابات داخلية (مثل عوامل استشعار) تُفعّل التغيير
- الآليات البيوكيميائية الذاتية: على سبيل المثال أنسجة تُفرز إنزيمات تؤثر على تركيبها أو صلابتها
6.3 أمثلة عملية
- نسيج غضروفي يُغيّر صلابته حسب الضغط الميكانيكي
- منصات مطبوعة قابلة للتوسع عند التعرض للرطوبة داخل المفاصل
- أنسجة داخلية تُحرّر عوامل النمو تلقائيًا عند حدوث جرح أو التهاب
6.4 صعوبات التنفيذ
- ضمان تناسق الحركة والتغيير مع بقاء الخلايا
- تصميم أنماط استجابة دقيقة دون تأثير سلبي على الوظيفة
- مقاومة التعب الميكانيكي والتآكل في البيئات الحيوية
7. تطبيقات الطباعة الحيوية في إصلاح الأعضاء والأنسجة التالفة
7.1 التطبيقات الجراحية والتجديدية
- طباعة جلد مخصّص لعلاج الحروق والجروح الكبيرة
- تجديد الغضاريف والعظام والمفاصل
- إعادة بناء الأوعية الدموية والأوردة
- طباعة أنسجة قلبية (عضلة القلب) أو صمامات
- تطعيم الأعضاء البسيطة مثل الكبد أو الكلى في النماذج المختبرية (tandfonline.com)
7.2 التطبيقات في الأبحاث والدواء
- نماذج أنسجة/أورام مخصصة للاختبار الدوائي (organoids أو tissue-on-a-chip)
- بحث السرطان وتفاعل الأدوية في بيئة ثلاثية الأبعاد
- إنتاج أنسجة الكبد لطراز التمثيل الغذائي الدوائي (arxiv.org)
7.3 حالات وتجارب واقعية
يُعد مشروع طباعة “قرص كبدي وظيفي” نموذجًا أوليًا يُنتج وظائف استقلابية مشابهة للنسيج البشري الأصلي بمعدلات إفراز الألبومين واليوريا. (arxiv.org)
في مجال الجراحة التجميلية، تُستخدم الطباعة الحيوية لتخصيص الدعائم والرقع الجلدية بدقة أعلى من الأساليب التقليدية. (BioMed Central)
8. التحديات التقنية والبيولوجية في تصميم أنسجة متكيفة داخل الجسم
8.1 التحديات التقنية
- دقة الطباعة عند الأحجام الصغيرة
- التحكم في مواضع الخلايا والتوزيع المكاني
- الربط بين الأجزاء المطبوعة (التلاصق البنيوي)
- استقرار البنية أثناء النضج
- التغذية داخل البنى السميكة (نقل الأكسجين والمواد المغذية) (MDPI)
8.2 تحديات بيولوجية
- بقاء الخلايا بعد الطباعة (Shear stress, thermal stress, irradiation) (BioMed Central)
- التكامل مع الأنسجة المحيطة والاستجابة المناعية
- الأوعية الدموية: تكوين شبكة وعائية داخل البنية
- استدامة الوظيفة على مدى الزمان
- التمايز الموجَّه والتحكم في النمو
8.3 التحديات التنظيمية والأخلاقية
- اختبار السلامة طويل الأمد
- الموافقة على تقنيات تعتمد على الخلايا المحورة وراثيًا
- معايير الجودة والتوحيد بين المختبرات
- القضايا الأخلاقية المرتبطة بالخلايا الجذعية وحقوق المرضى
9. التوافق الحيوي (Biocompatibility) والتكامل مع أنسجة الجسم الطبيعية
9.1 مفهوم التوافق الحيوي
التوافق الحيوي هو قدرة المادة المطبوعة على التعايش مع البيئة الحيوية داخل الجسم دون أن تسبب استجابة مناعية شديدة أو تسمم، مع دعم نمو الخلايا الطبيعية من دون تهيج أو التهاب.
9.2 خصائص يجب توفرها في المواد الحيوية
- خلوها من السمية
- قابلية التدهور (Degradability) بمعدل مناسب
- نفاذية جيدة للأكسجين والمواد المغذية
- بنية مسامية تسمح بالترابط الخلوي
- سطح يشجع التصاق الخلايا وتفاعلها
9.3 استراتيجيات لتحسين التكامل
- تغليف المواد بسطح ببتيدي (مثل RGD)
- ضبط الهيكل النانوي لتقليد المصفوفة الطبيعية
- استخدام عوامل النمو المدمجة تدريجيًا
- تحفيز النمو الوعائي (angiogenesis) داخل البنية
9.4 التحديات في التكامل
- احتمال التليف أو تكوين نسيج ندبي حول البنية
- التفاوت في خواص الميكانيك بين البنية والأنسجة المحيطة
- عودة المواد إلى الجسم خلال التدهور قد تُطلق منتجات غير مرغوبة
10. المحاكاة الحيوية (Biomimicry) كنموذج لتصميم أنسجة وظيفية متطورة
10.1 مفهوم المحاكاة الحيوية
المحاكاة الحيوية تعني الاستلهام من بنية أو وظيفة الأنسجة الطبيعية في تصميم المواد والهياكل الاصطناعية، بحيث تقترب من خصائص الأنسجة الحقيقية (الميكانيكية، البنائية، التفاعلية).
10.2 أمثلة في التصميم
- محاكاة القنوات الوعائية الصغيرة (microvascular networks) كما في الأنسجة الحقيقية
- استخدام أنماط نانوية تحاكي ألياف الكولاجين في ECM
- تصميم هياكل متعددة الطبقات تشبه الجلد أو الغضروف
10.3 دور المحاكاة في تحسين الأداء
- تحسين الانتشار الغذائي داخل البنية
- تنظيم التمايز الخلوي بشكل أفضل
- تعزيز ترابط الخلايا وتوزيعها
- تقليل الصدمات الميكانيكية بفضل توزيع شبيه بالأنسجة الأصلية
10.4 التحديات
- التعقيد في تكرار البنى النانوية الدقيقة
- التوازن بين الدقة وسرعة التصنيع
- المحافظة على الوظائف المعقدة في بنية محاكية
11. التحكم بالتحفيز البيوكيميائي والميكانيكي لاستجابة الأنسجة المطبوعة
11.1 أنواع التحفيزات الممكنة
- تحفيز ميكانيكي: تحميلات شد أو ضغط أو اهتزاز
- تحفيز كهربائي / مغناطيسي: مجالات تؤثر على نمو الأعصاب أو أنسجة القلب
- التحفيز الكيميائي / البيوكيميائي: إطلاق عوامل النمو، هرمونات، جزيئات إشارات
- التحفيز البصري / الليزري: ضوء يُستخدم لتنشيط تفاعلات داخل البنية
11.2 كيفية الدمج
- تضمين ميكروفلويديكات مدمجة داخل البنية لتوصيل عوامل النمو
- استخدام مواد مع تحميلات مغناطيسية/كهروضوئية للتحفيز البعيد
- تصميم بٍنى ميكانيكية قادرة على تغيير الشكل تحت التحميل
11.3 الأهداف المرجوّة
- توجيه التمايز الخلوي إلى النوع المطلوب
- تعزيز التوسع الخلوي وتكوين الأنسجة
- تنشيط الإنتاج البروتيني أو إفراز العوامل العلاجية
11.4 التحديات
- تحقيق دقة في التوزيع المكاني للتحفيز
- ضمان عدم التأثير السلبي على البنية أو الخلايا
- متطلبات الطاقة والتحكم داخل الجسم
12. التطورات الحديثة في تقنيات الطباعة الحيوية متعددة المواد (Multi-material Bioprinting)
12.1 التعريف والفائدة
الطباعة متعددة المواد تعني دمج عدة أنواع من bioinks (خلايا مختلفة، مواد داعمة متنوعة) في طابعة واحدة لتحقيق تركيب معقَّد متعدد الخواص ضمن بنية واحدة.
12.2 الأمثلة والتقنيات
- طابعات مزوّدة برؤوس متعددة تُعطي خلطًا أو فصلًا بين المواد
- دمج ألياف أو مواد صلبة مع الهيدروجيلات
- استخدام أنماط متداخلة (interpenetrating networks)
12.3 الفائدة في الأنسجة المتكيفة
- إمكانية إدماج مواد استجابية مع مواد ثابتة ضمن نفس البنية
- تخصيص مناطق تحمل ميكانيكي وأخرى مرنة ضمن التصميم
- تحسين توزيع الخلايا المتعددة داخل البنية
12.4 التحديات
- تباين في خصائص الربط بين المواد المختلفة
- الانكماش التفاضلي أو النزوح أثناء النضج
- توافق لزوجة المواد المختلفة مع نفس عملية الطباعة
- تعقيدات التحكم في التصاق الوظائف المختلفة
13. المستقبل: من الطباعة الحيوية إلى تصنيع الأعضاء الكاملة القابلة للتكيف الذاتي
13.1 الرؤية المستقبلية
الاتجاه المستقبلي هو الانتقال من الهياكل النسيجية البسيطة إلى تصنيع أعضاء كاملة (قلب، كبد، كلى) قادرة على النمو والتكيف مع بيئة المريض بعد الزرع.
13.2 الابتكارات المتوقعة
- طباعة مع شبكات وعائية معقدة متكاملة
- إدماج أجهزة استشعار حيوية داخل الأنسجة
- استخدام الذكاء الاصطناعي لتوجيه عملية الطباعة والتكيف
- الأعضاء القابلة للإصلاح الذاتي والتجديد المستمر
13.3 التحديات الرئيسية التي يجب تجاوزها
- الاتساع الشاسع في الأنسجة (حجم الأعضاء) والحفاظ على التروية
- سلامة الخلايا على مدى سنوات
- المراقبة والتحكّم في استجابة الجسم المناعية
- التشريعات والمعايير لتصنيع الأعضاء البشرية
14. الاعتبارات الأخلاقية والتنظيمية في الطباعة الحيوية للأعضاء البشرية
14.1 القضايا الأخلاقية
- استخدام الخلايا الجذعية أو الكائنات المحورة وراثيًا
- حقوق المرضى والسيطرة على بيانات الأنسجة البيولوجية
- إمكانية إساءة الاستخدام (تعديل الأنسجة لأغراض غير علاجية)
- العدالة في الوصول إلى التقنيات المتقدمة
14.2 التنظيم والمعايير
- اعتماد جهات رقابية (مثل الهيئات الصحية الوطنية والدولية)
- معايير جودة صارمة للبيوكيمياء، البقاء الخلوي، والوظائف
- تجارب سريرية مرحلية وفحوص طويلة الأمد
- اللوائح لضمان أن الأعضاء المطبوعة آمنة للاستخدام البشري
15. الاتجاهات البحثية المستقبلية في تصميم الأنسجة القابلة للتغير والتكيف داخل الجسم
- دمج الذكاء الاصطناعي والتعلّم العميق (Machine Learning / Deep Learning) لتحسين تصميم البنى المتغيرة ذاتيًا
- التوسع في البناء الحيوي في الفضاء الخالي من الجاذبية لتخفيف التوترات أثناء الطباعة (أحد التطوّرات الحديثة المقترحة) (PubMed)
- تطوير مواد استجابية متعددة المحفزات (تجمع بين الحرارة، pH، المجال الكهربائي في مادة واحدة)
- الأعضاء المطبوعة التي تدمج أجهزة استشعار لقياس الحالة الحيوية والتكيّف التلقائي
- تجارب ما بعد الزرع طويلة المدى في نماذج حيوانية لتقييم المتانة الوظيفية والتكيف طويل الأجل
- التعاون بين التخصصات (هندسة، بيولوجيا، علوم المواد، الذكاء الاصطناعي) لتسريع الترجمة من المختبر إلى العيادة
المراجع:
إليك قائمة مراجع علمية مرجعية يمكن استخدامها مع روابط واضحة (لتحسين المصداقية والسيو):
- “3D bioprinting and its innovative approach for biomedical applications”
— مراجعة شاملة تغطي المواد والتطبيقات في الهندسة النسيجية والطباعة الحيوية. (pmc.ncbi.nlm.nih.gov) - “3D bioprinting in tissue engineering: current state-of-the-art and future directions”
— تسلّط الضوء على التحديات التقنية والاتجاهات الحديثة. (PubMed) - “Advances and future perspectives in 4D bioprinting”
— تتناول الطباعة الحيوية رباعية الأبعاد، المواد الاستجابية، والتحديات. (pmc.ncbi.nlm.nih.gov) - “4D bioprinting of smart polymers for biomedical applications”
— تركيز على المواد الذكية والتطبيقات البيولوجية. (sciencedirect.com) - “Transformative bioprinting: 4D printing and its role in the future of tissue engineering”
— يوضح كيف يمكن للطباعة الحيوية أن تدمج عنصر الزمن ضمن الأنظمة البيولوجية. (link.springer.com) - “A Review on Techniques and Biomaterials Used in 3D Bioprinting”
— تفصيل للتقنيات المختلفة والمواد المستخدمة في الطباعة الحيوية ثلاثية الأبعاد. (pmc.ncbi.nlm.nih.gov) - “A Review of Bioprinting Techniques, Scaffolds, and Bioinks”
— مرجع جيد للتعرف على أنماط البيوكشط والهياكل الداعمة. (pmc.ncbi.nlm.nih.gov) - “Systematic review on the application of 3D-bioprinting technology in orthoregeneration”
— تغطية للتطبيقات في تجديد العظام والغضاريف. (pmc.ncbi.nlm.nih.gov)




